und Naturwissenschaften
Wirkmechanismus entschlüsseltPaenilamicine stellen eine vielversprechende neue Klasse von Antibiotika dar
17. Oktober 2024, von MIN-Dekanat
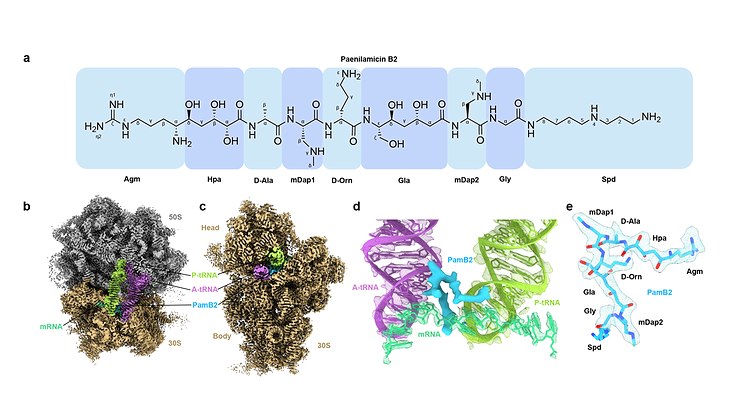
Foto: UHH/Wilson
Paenilamicine sind Verbindungen, die gegen verschiedene bakterielle Krankheitserreger wirken. Nun haben Forschende unter Leitung des Fachbereichs Chemie der Universität Hamburg den Wirkmechanismus dieser Verbindungen entschlüsselt. Die Ergebnisse machen die Paenilamicine zu einer attraktiven Klasse von Verbindungen für die Entwicklung neuartiger Antibiotika und wurden im Fachjournal „Nature Chemical Biology“ veröffentlicht.
In der Behandlung von Infektionskrankheiten spielen Antibiotika eine wichtige Rolle. Allerdings werden immer mehr Bakterien unempfindlich und bilden Resistenzen gegen verschiedene Antibiotika-Wirkstoffe. Eine potenzielle neue Klasse von Antibiotika könnten die Paenilamicine darstellen, die von dem Bakterium Paenibacillus larvae produziert werden. Paenibacillus larvae ist der Erreger der Amerikanischen Faulbrut – einer bakteriellen Krankheit, die Honigbienen befällt und unter Umständen zum Absterben des gesamten Bienenvolkes führen kann.
Studien konnten bereits zeigen, dass Paenilamicine gegen verschiedene Bakterien wie Staphylococcus aureus wirksam und dabei nachweislich viermal effektiver als das Standardmedikament Ciprofloxacin sind. Staphylococcus aureus besiedelt viele Menschen, ohne dass diese etwas davon merken. Im Falle eines geschwächten Immunsystems kann das Bakterium jedoch Wundinfektionen bis hin zur Blutvergiftung hervorrufen. Viele Varianten von Staphylococcus aureus sind gegen herkömmliche Antibiotika resistent.
Obwohl Forschende bereits nachgewiesen haben, dass Paenilamicine die Proteinbiosynthese hemmen, ist ihr genauer Wirkmechanismus noch unklar. Expertinnen und Experten vermuten, dass die Wirkung auf einer Bindung von Paenilamicin an Ribosomen beruht. Ribosomen sind große Moleküle und kommen in den Zellen von Pflanzen, Tieren, Menschen sowie Bakterien vor und stellen bei der Proteinbiosynthese essentielle Proteine her.
Ein internationales Forschungsteam um Prof. Dr. Daniel Wilson vom Fachbereich Chemie der Universität Hamburg hat nun Ribosomenkomplexe mit Paenilamicin (PamB2) hergestellt und mithilfe der Kryo-Elektronenmikroskopie untersucht. „So konnten wir eine einzigartige Bindungsstelle für PamB2 identifizieren. Die Strukturen liefern nicht nur eine genaue Beschreibung der Interaktionen von PamB2 mit dem Ribosom, sondern erklären auch die von Paenibacillus larvae genutzten Resistenzmechanismen,“ sagt Prof. Wilson.
„Auf der Grundlage unserer Ergebnisse schlagen wir ein Modell für den Wirkmechanismus vor, wie PamB2 an das Ribosom bindet und die Proteinbiosynthese hemmt. Zusammen mit der guten Aktivität gegen Staphylococcus aureus macht dies die Paenilamicine zu einer attraktiven Klasse von Verbindungen für die künftige Entwicklung von Mitteln zur Bekämpfung arzneimittelresistenter Bakterien“, ergänzt Max Berger, Doktorand in der Arbeitsgruppe von Prof. Daniel Wilson und Mitautor der Studie.
Weitere Informationen
Originalpublikation:
Koller, T.O., Berger, M.J., Morici, M. et al. Paenilamicins are context-specific translocation inhibitors of protein synthesis. Nat Chem Biol (2024). https://doi.org/10.1038/s41589-024-01752-9
Weitergehende Informationen zur Forschung von Prof. Wilson finden Sie hier.