und Naturwissenschaften
Kryo-Elektronenmikroskopie:Forschungsteam der Universität Hamburg identifiziert Aufbau von 100S-Ribosomen
4. September 2018, von Maria Latos
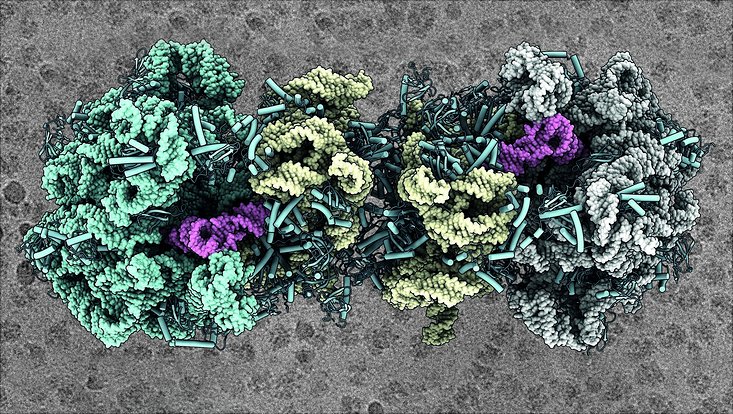
Foto: UHH/Beckert
Einem Forschungsteam um Dr. Bertrand Beckert aus dem Fachbereich Chemie der Universität Hamburg ist es gelungen, die genaue Bindung verschiedener Moleküle an 100S-Ribosomen von Bakterien zu identifizieren. Das Wissen könnte den Weg für die Entwicklung von neuartigen Antibiotika und anderen antimikrobiellen Substanzen ebnen. Die Ergebnisse wurden im Fachjournal „Nature Microbiology“ veröffentlicht.
Ribosomen sind große Moleküle, die aus sogenannten Ribonukleinsäuren und Proteinen aufgebaut sind. Sie kommen in den Zellen von Pflanzen, Tieren, Menschen sowie Bakterien vor und dienen dazu, wichtige Proteine herzustellen. Prinzipiell lassen sich zwei Typen von Ribosomen unterscheiden: der 80S- und der 70S-Typ. Das „S“ steht für „Svedberg-Einheiten“ und bezeichnet die Masse der Ribosomen. 70S-Ribosomen kommen in Bakterien wie Escherichia coli vor – einem Kolibakterium, das sich auch im menschlichen Darm befindet. Ein E. coli Bakterium kann bis zu 20.000 Ribosomen besitzen.
Um in Stresssituationen wie Nahrungsmangel länger überleben zu können, fahren Bakterien ihren Stoffwechsel herunter. Dabei wird auch die energieaufwendige Proteinsynthese reduziert. Dazu verbinden sich jeweils zwei aktive 70S-Ribosomen zu einem inaktiven 100S-Komplex. Mithilfe der Kryo-Elektronenmikroskopie haben die Wissenschaftlerinnen und Wissenschaftlern um den Biochemiker Dr. Bertrand Beckert die genaue Bindung verschiedener Moleküle an ein 100S-Ribosom des Bakteriums Escherichia coli (E. coli) identifiziert.
Damit sich die Ribosomen zusammenlagern können, benötigen sie zwei Moleküle, den sogenannten „Ribosome Modulation Factor“ (RMF) und den „Hibernation Promoting Factor“ (HPF). Obwohl bereits verschiedene 3D-Modelle von 100S-Ribosomen existieren, verhinderte die geringe Auflösung der Mikroskope bis jetzt, dass Wissenschaftlerinnen und Wissenschaftler die Bindung von RMF und HPF genau identifizierten konnten.
Dies ist der Arbeitsgruppe von Prof. Dr. Daniel N. Wilson, zu der Dr. Bertrand Beckert gehört, nun gelungen. Zudem waren die Arbeitsgruppen von Prof. Dr. Zoya Ignatova (Universität Hamburg), Prof. Dr. Jürgen M. Plitzko (Max-Planck-Institut für Biochemie) und Prof. Dr. Roland Beckmann (Ludwig-Maximilians-Universität München) beteiligt. Dabei konnten noch zwei weitere Moleküle identifiziert werden, die an das Ribosom binden: sogenannte Transfer-RNA und das Protein bS1.
Da vor allem RMF und HPF in verschiedenen Bakterien auch eine wichtige Rolle bei der Entstehung von Antibiotikaresistenzen spielen, könnte das Wissen über den genauen Aufbau des 100S-Ribosoms dazu beitragen, neue antimikrobielle Substanzen wie Antibiotika zu entwickeln, die an diesem Punkt ansetzen.

Dr. Bertrand Beckert im Labor der Universität Hamburg. (Foto: UHH/Koller)
Weitere Informationen
Bertrand Beckert, Martin Turk, Andreas Czech, Otto Berninghausen, Roland Beckmann, Zoya Ignatova, Jürgen M. Plitzko and Daniel N. Wilson (2018): Structure of a hibernating 100S ribosome reveals an inactive conformation of the ribosomal protein S1; Nature Microbiology; DOI: 10.1038/s41564-018-0237-0


